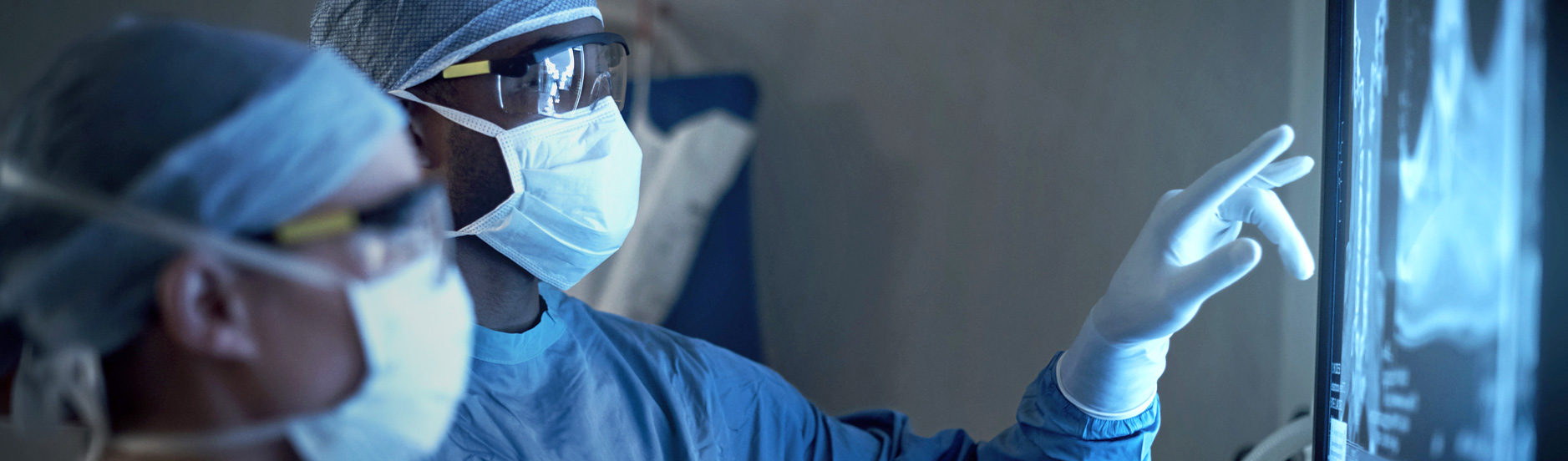
Ob Systeme zur Lebenserhaltung, Überwachung, Diagnose oder Therapie, die von Ärzten, medizinischem Personal oder den Patienten selbst genutzt werden – wir gestalten innovative Medizinprodukte, die sicher und intuitiv zu bedienen sind, und unterstützen Sie bei der Zulassung.
Unser fundierter Ansatz verknüpft das Human Centered Design nach ISO 9241 mit dem Medical Safety Design nach ISO 62366. Dabei berücksichtigen wir die Ansprüche von Normen und Endnutzern an Funktionalität, Qualität und Sicherheit bereits bei der Ideenfindung. So stellen wir von Anfang an die spätere Marktakzeptanz sicher.
Mit nutzerzentrierten Produkten und Services können Sie sich nicht nur von Ihren Wettbewerbern unterscheiden, sondern innerhalb Ihrer Produktkategorie neue Maßstäbe setzen. Sie verbessern die Bindung zu Ihren Kunden und stärken Ihre Marke. So trägt eine benutzerfreundliche Produktentwicklung langfristig zu Ihrem wirtschaftlichen Erfolg bei.
Als Partnerunternehmen von YOOme decken wir darüber hinaus den gesamten Lebenszyklus von Medizinprodukten ab. Sie als Hersteller greifen über YOOme auf alle Leistungen der gesamten Medizinprodukte Journey zu: Ideenfindung, Konzeption und Requirements Engineering, medizinische Hard- und Softwareentwicklung, Cybersecurity, Validierung und Verifizierung, Design, Usability & UX, Inverkehrbringung und Maintenance.
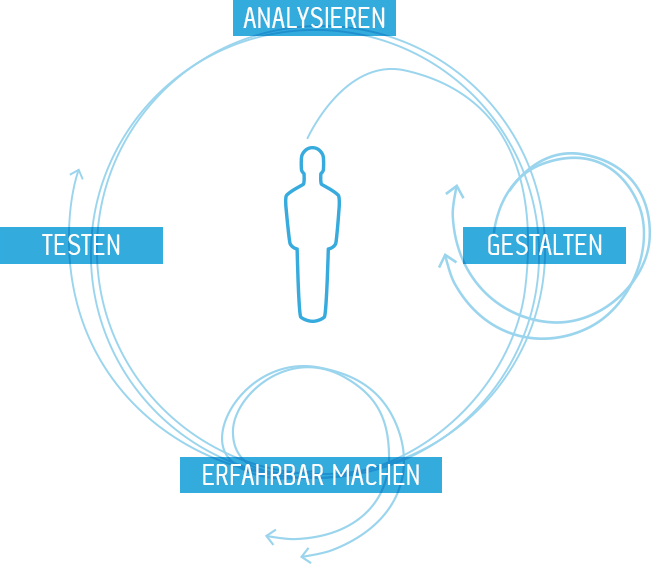
Abbildung: Der Human-Centered-Design-Prozess nach ISO 9241
- Entwicklung von Produktideen
- Evaluation und UX Strategie für langfristigen Markterfolg
Wir helfen Ihnen, Ideen für neue Produkte, Produktökosysteme und Services zu entwickeln und Innovationspotenzial für bestehende Produkte zu identifizieren. Damit jede Idee auf einem tatsächlichen Bedarf basiert, beziehen wir die Nutzer bei sämtlichen Aktivitäten mit ein – von der qualitativen Nutzerforschung bis zur Ideenfindung. Hierzu wenden wir bewährte und innovative Methoden an, zum Beispiel aus dem Design Thinking und Service Design.
Wenn eine Idee bereits gereift ist, evaluieren wir ihr Potenzial, insbesondere hinsichtlich Marktakzeptanz und User Experience und erarbeiten mit Ihnen eine Strategie, damit Ihr Produkt oder Service wirtschaftlich erfolgreich ist.

- Erhebung der User Requirements
- Beschreibung der Use Cases und Personas
Erfolgreiche Produkte bringen ihren Nutzern einen klaren Mehrwert und fügen sich dabei nahtlos in bestehende Prozesse und Gegebenheiten ein. Wir helfen Ihnen dabei, dass Ihr Produkt genau diese Anforderungen erfüllt – durch effiziente Analysen des Nutzungskontextes mit Nutzerkontakt.
Die Ergebnisse aus der Analysephase dokumentieren wir gemäß IEC 62366:2016 u .a. in Use Cases und Personas, die die Basis für die (Weiter-) Entwicklung und Zulassung Ihres Produkts bilden.

- Entwicklung von Informationsarchitektur und Bedienkonzept
- Entwicklung eines visuellen Designs
- Entwicklungsbegleitende Evaluation
- Implementierung in allen relevanten Programmiersprachen
- Erstellung der User Interface Specification
- Expert Review und begleitende Beratung für die Erstellung Ihrer Instructions for Use
In einem iterativen Prozess setzen wir Nutzeranforderungen in sichere und nutzerfreundliche Interaktionskonzepte um. Mit geschultem Blick für die Bedürfnisse der Nutzer gestalten wir intuitiv bedienbare Produkte und Services mit hochwertigem Design.
Wir machen die UI-Konzepte bereits früh als Prototyp erfahrbar, um sie in formativen Evaluationen zu überprüfen und kontinuierlich zu verbessern.
Unsere Software Engineers sind Spezialisten für Graphical User Interfaces – egal ob Embedded, Health Apps oder Stand-Alone Health Software (nach IEC 82304-1). In enger Zusammenarbeit mit unseren UX Experten setzen sie die UI-Konzepte um.
Als Grundlage für die Zertifizierung erstellen wir die User Interface Specification nach IEC 62366:2016.
Darüber hinaus beraten wir Sie beim Erstellen Ihrer Gebrauchsanweisung (Instructions for Use (IFU)) oder überprüfen sie hinsichtlich User Experience und Normkonformität.

- Prozessbegleitende Beratung bis zur Zertifizierung
- Planung, Durchführung, Auswertung und Dokumentation von summativen Studien
- Normenkonforme Dokumentation (UEF) für die Produkt-Zertifizierung
Wir verfügen über langjährige Erfahrung in der Entwicklung von Medizinprodukten und kennen die Anforderungen für die Zertifizierung (FDA, CE, …). Daher stehen wir Ihnen während des gesamten Produktentwicklungsprozesses bis zur Zertifizierung bei allen, die Usability betreffenden Fragen beratend zur Seite.
Mit der summativen Evaluation weisen wir nach, dass Nutzer Ihr Medizinprodukt sicher verwenden können. Dabei unterstützen wir Sie bei der Planung, Durchführung, Auswertung und Dokumentation von summativen Studien.
Alle Services und Projektergebnisse dokumentieren wir normgerecht, so dass Sie diese für die Einreichung Ihrer Gebrauchstauglichkeitsakte (Usability Engineering File (UEF)) bei der Zertifizierung verwenden können.


Für mehr Informationen besuchen Sie uns auf www.uid.com

Für mehr Informationen besuchen Sie uns auf www.uid.com

Weitere Medical-Projekte finden Sie auf www.uid.com


Alle unsere Prozesse sind ISO 9001 zertifiziert. So stellen wir eine gleichbleibend hohe, auditierbare Qualität bei all unseren Projekten und Standard Operating Procedures sicher.
Durch die Vielzahl unserer Medical-Projekte haben sich unsere Usability-Experten Hintergrundwissen zu verschiedenen Produkt-Kategorien und Risiko-Klassen erarbeitet. Das ermöglicht uns, schnell in Ihr Projekt einzusteigen. Unter anderem blicken wir auf Projekte aus folgenden Produktkategorien zurück:
- Lebenserhaltungssysteme wie Beatmungsgeräte, Anästhesiegeräte
- Überwachungsgeräte wie Lungenmonitore
- Diagnose-Systeme wie Blutzuckermessgeräte
- Therapeutische Systeme wie Injektionspens, Insulinpumpen und Inhalatoren
- Medical Apps
Unsere Mitarbeiter sind Mitglieder der German Usability Professional Association, dem deutschen Berufsverband für Usability- und User-Experience-Experten, und liefern normenkonforme Ergebnisse. Sie bilden sich regelmäßig in internen Workshops und externen Medizintechnik-Seminaren weiter. Zudem sind sie Certified Professionals for Usability and User Experience (CPUX).
fon +49 (0) 7141 3 77 00 0
mail anfragen@uid.com
UID GmbH
Europaplatz 5
64293 Darmstadt
Postanschrift
Wilhelm-Bleyle-Straße 10
71636 Ludwigsburg